このn-ブチルアルコール抽出物から、MAFを抽出分離するために、カラムクロマトグラフィーを行いました。小澤先生が行ったカラムクロマトグラフィーは、直径2.4cm、長さ35cmのガラス管(これをカラムと呼ぶ)の先を細くつぼめたものに、トヨパールHW-40Fという樹脂を詰めたものでした。
球状のトヨパールHW-40F樹脂には、直径5nm(ナノメートル)の小さな穴がたくさん開いています。1nmは1mmの百万分の1です。5nmより小さな物質はこの穴に入ってしまいますが、大きなものはこの穴に入らず素通りしてしまいます。
したがって、トヨパールHW-40Fを充塡(じゅうてん)したカラムに物質を流すと、大きな分子は早く流れ出ますが、小さい分子は穴に入ってしまい遅れて流れ出てきます。その結果、物質の大きさで分離が可能になるわけです。
n-ブチルアルコール抽出物0.3gを20%アセトンに溶かして、トヨパールHW-40Fを充塡したカラムに乗せました。
カラムからの物質の溶出は、アセトン濃度を20%から50%まで徐々に上げる条件で溶出しました。溶出速度は1分間に0.3mlで行いました。溶出してくる溶液は5gずつ試験管に集め、全部で230本の試験管に分けました。
これらに含まれるカテキンなどのポリフェノールの量を、吸光光度計を用いて、波長350nmでの吸光度で測定しました。ポリフェノール量が多いと吸光度は大きくなります。
その測定結果を、(図1)の上部に示します。このグラフを溶出パターンと呼びます。溶出されたサンプルを11個の分画に分け、どの分画にMAFが存在するか、テトラヒメナを用いた検定方法で測定しました。
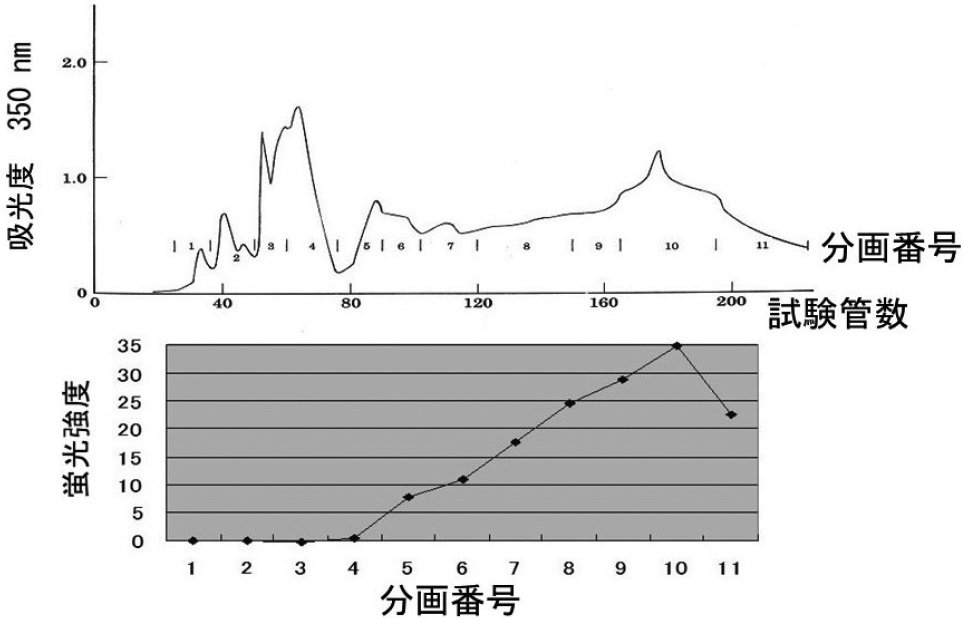
その測定結果が、(図1)の下部です。MAFは、後半の分画9から11に多いことがわかりました。
分画9から11で、処理したテトラヒメナは、ローダミン123で染色すると、ミトコンドリアがとても強く光っていました。
これはミトコンドリアの電子伝達系の働きが亢進(こうしん)して、その結果、多くの水素イオンが膜間腔にくみ出され、膜電位が上昇していることを示します。この水素イオンはATP合成に使われるのです。
そこで、分画9から11が、テトラヒメナのATP合成量や酸素消費量を増加させるかどうかを測定しました。その結果、分画9から11は、ATP合成量を30%から40%増加させ、酸素消費量も増加させることがわかりました。
これまで、ミトコンドリアの酸素呼吸を阻害する物質、例えば、電子伝達系複合体Ⅰを阻害するロテノン、複合体Ⅲを阻害するアンチマイシンA、複合体Ⅳを阻害する青酸カリ(KCN)やアジ化ナトリウム(NaN3)などは知られていました。
しかし、ミトコンドリアの酸素呼吸を活性化させる物質はまだ知られていませんでした。ということで、私たちはMAFの実体を何としても解明したいと思い、研究への情熱の炎はますます燃え上がりました。

















